局部晚期肺癌经再程放疗后获得长期生存
2025-10-16 16:54
阅读:5985
来源:爱爱医
作者:张建鑫
责任编辑:点滴管
[导读] 局部晚期非小细胞肺癌(NSCLC)经根治性放化疗后的孤立性局部复发是临床面临的挑战。手术切除机会渺茫,而再次放疗则因正常组织,特别是脊髓、肺组织的耐受剂量限制而风险极高。
局部晚期非小细胞肺癌(NSCLC)经根治性放化疗后的孤立性局部复发是临床面临的挑战。手术切除机会渺茫,而再次放疗则因正常组织,特别是脊髓、肺组织的耐受剂量限制而风险极高[1]。近年来,免疫检查点抑制剂(ICIs)彻底改变了晚期NSCLC的治疗格局。PACIFIC研究确立了度伐利尤单抗在同步放化疗后巩固治疗的标准地位[2],但其高昂费用限制了临床应用。本文报道一例患者,在MDT指导下成功接受再程放疗,并序贯国产PD-1抑制剂维持治疗,获得长期生存,为此类患者的治疗提供了新思路。
病史资料
男性,61岁 ,因“确诊左肺癌4月余,痰中带血3天”入院。患者于2020年6月30日因"咳嗽、咳痰"在家人陪同下前往滕州某医院行健康查体,行胸部CT提示左肺上叶占位性病变,左肺门及纵隔4R区可见肿大淋巴结(图1)。2020年7月3日行CT引导下肺穿刺活检,病理检查示:(左肺穿刺活检)分化差的癌,结合免疫组化结果考虑鳞状细胞癌。免疫组化示:CK广(+) CK5/6(+), P40(+),TF-1(-),CX7(-),CD56(-), NapsinA(-),CgA(-),Syn(-),Ki67(约50%阳性)。2020年7月-10月在外院完成“(白蛋白型)紫杉醇300mg,d1+洛铂50mg,d1”化疗3个周期,2020年10月20日复查胸部CT,肿瘤较前缩小,疗效评价PR(图2),患者因IV度骨髓抑制,严重乏力、纳差未在继续化疗。近3日患者出现咳嗽,痰中带血3天,病人为求进一步治疗到我院就诊,门诊以“左肺癌”收入院。患者吸烟20年,20支/日,偶尔饮酒。既往史、婚育史、家族史无特殊。
体格检查:BP :135/80mmHg,P:85次/分,R:22次/分,T:36.5℃,H158 cm,W 60kg,BS 1.71,ECOG 1分。两肺呼吸音粗,未闻及干湿啰音。心率85次/分,律齐,未闻及病理性杂音。腹软,肝脾肋下未及,移动性浊音(-)。
辅助检查:肝功、肾功、血离子、血常规、血凝、尿常规、心电图、颈部超声、肝胆胰脾超声、颅脑MR未见异常,胸部CT见图1-2。
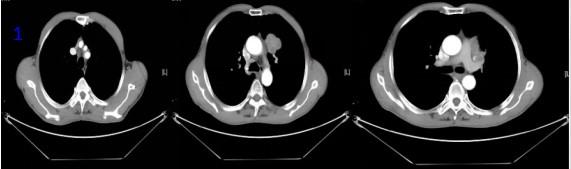
图1胸部CT:左肺肿瘤及肿大淋巴结
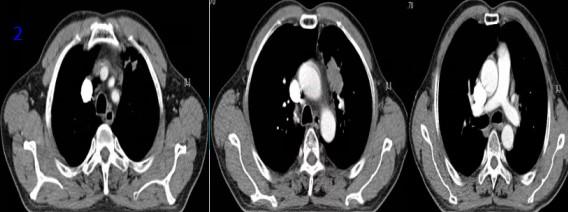
图2 胸部CT可见肿瘤经化疗后减小
初步诊断:左肺鳞癌,cT3N3M0,IIIC期,纵膈淋巴结转(4R区),肺门淋巴结转移移
第一次MDT讨论与治疗情况
讨论情况
病理科意见:患者病理报告,(左肺穿刺)组织镜下为分化差的癌。免疫组化染色结果显示:CKpan(+)、CK5/6(+)、P40(+),此三联标记强阳性高度支持鳞状细胞癌的诊断。同时,甲状腺转录因子-1(TTF-1)、NapsinA阴性有效排除了肺腺癌;CD56、CgA、Syn阴性排除了神经内分泌肿瘤。Ki-67增殖指数约50%,提示肿瘤增殖活性较高,符合鳞癌生物学特性。目前无进行PD-L1表达检测的信息,若后续考虑免疫治疗,建议尽可能补测PD-L1表达水平,为治疗决策提供更多依据。
影像科:患者2020年6月基线胸部CT提示左肺上叶中央型肿块,符合原发性肺癌影像学表现。同时存在左肺门及4R组淋巴结肿大,最大短径均超过1cm,考虑淋巴结转移。根据第8版肺癌TNM分期,4R区淋巴结转移归类为N3。如病人条件允许,可行PET-CT检查,PET-CT能全面评估全身代谢情况,精确判断纵隔淋巴结(N3)的活性,并明确有无其他潜在的远处转移灶(M1),这对于IIIC期患者的分期确认和放疗靶区勾画至关重要。
胸外科:患者临床分期为cT3N3M0 IIIC期。根据目前国际指南,同侧纵隔对侧(4R区属于上纵隔,相对于左肺原发灶,可视为对侧纵隔)的N3淋巴结转移属于绝对不可切除范畴。强行手术无法达到R0切除,预后极差,且不能带来生存获益。因此不建议行根治性手术治疗。外科在本患者治疗中的角色有限,可能仅限于诊断性穿刺或未来若出现并发症(如大咯血不止)时的姑息性干预。当前治疗应以内科和放疗科为主导。
肿瘤内科:患者对“白蛋白紫杉醇+洛铂”方案化疗敏感(达到PR),但耐受性极差,出现了IV度骨髓抑制,导致治疗中断。这表明患者体能状态(PS)和骨髓储备功能较差,尽行下一周期化疗可考虑更换骨髓抑制较轻的药物。患者目前分期cT3N3M0,有时常规影像检查不能发现远处转移灶,建议行PET-CT检查进行全面的分期。患者目前PD-L1表达不知,建议补充PD-L1检查,指导后续免疫治疗。若该患者排除远处转移,首选同步放化疗,备选序贯放化疗;如患者拒绝强烈化疗,可根据PD-L1表达选择免疫治疗或单纯放疗;若检查发现远处转移,则转为姑息性全身治疗为主。
放疗科:对于IIIC期不可切除的NSCLC,根治性同步放化疗是标准治疗方案。患者化疗有效但因毒性中断,放疗是提供局部根治性机会的最重要手段。患者前期化疗有效,目前患者痰中带血提示肿瘤可能再次活动,放疗对止血有良好效果。应在患者身体状况允许的情况下,尽快启动根治性放疗。放疗靶区需覆盖左肺上叶原发灶、受累的肺门淋巴结及4R区纵隔淋巴结。采用适形调强放疗(IMRT) 技术,以保护脊髓、食管、心脏、正常肺组织(尤其是右肺),最大限度地降低放射性肺炎、食管炎等风险。根治性剂量通常为60-66Gy/30-33次。考虑患者刚刚发生的IV度骨髓抑制史,化疗药物可选择骨髓抑制较轻的依托泊苷和顺铂。放疗结束后,若疾病得到控制,可根据PD-L1表达情况,考虑使用度伐利尤单抗(I药)进行巩固免疫治疗(基于PACIFIC研究模式),以进一步延长生存。
讨论意见
1.如患者条件允许进一步全身PET-CT,进行精确的再分期和放疗靶区规划。同时,设法检测肿瘤组织PD-L1表达。
2.若全身评估仍确认为IIIC期(无远处转移),首选:根治性同步放化疗,化疗方案选择EP方案, 需要与患者及家属充分沟通获益与风险(尤其是血液学及食管毒性)。 若患者拒绝化疗,则行根治性放疗(如60-66Gy/30-33f)。若全身评估发现远处转移(M1),则治疗目标转为姑息治疗。
治疗情况
经与患者及家属沟通,病人因经济条件限制,暂时不进行PET-C和PD-L1检测,接受同步放疗。患者于2020年10月21日开始同步放化疗,期间完成2周期EP方案化疗(依托泊苷150mgd1-3+顺铂40mgd1-3),左肺肿瘤及转移淋巴结完成放疗总量60Gy/30次,4R、4L、5区、6区、肺门淋巴引流区及亚临床病灶完成放疗剂量50Gy/25次,脊髓:max≤43.56Gy; 双肺:mean ≤15Gy,V20≤20%,V5≤35%;心脏:V30≤3%,;2020年11月31日顺利结束。治疗结束后建议病人使用度伐利尤单抗维持治疗,因经济受限未使用,后续进入随访观察。
观察随访
2020年12月29日,放疗后1个月复查胸部CT可见肿瘤及转移淋巴结较前缩小(图3),RECIST评价,PR。
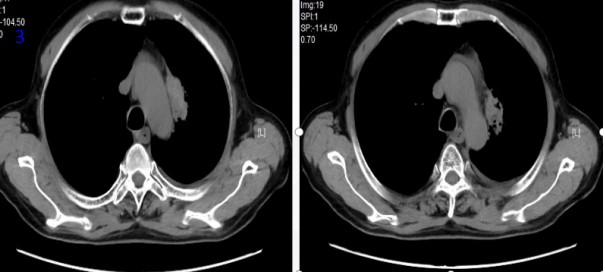
图3 放疗后1月胸部CT
2021年3月19日,放疗后3个月,因胸闷、憋喘复查胸部CT可见双肺炎性病变,肿瘤继续缩小(图4),考虑放射性肺炎给与甲泼尼龙对症治疗好转。
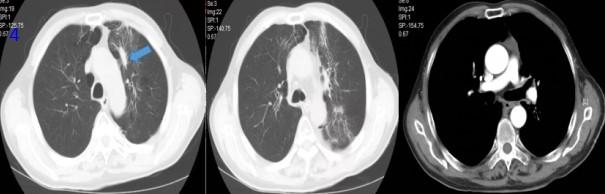
图4 放疗后3个月胸部CT
2021年8月30日,放疗后9个月,胸部CT可见左肺肿瘤较2021年3月19日明显增大(图5), RECIST评价,PD。
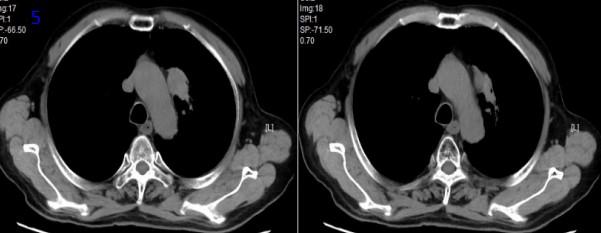
图5放疗后9个月胸部CT
第二次MDT讨论与治疗情况
讨论情况
胸外科:患者为放疗后局部复发,且仍伴有N3淋巴结(4R区)转移。这种情况属于非常晚期的局部区域性疾病。手术面临巨大挑战:① 放疗后组织纤维化、粘连严重,解剖层次不清,手术难度极高,出血风险大。② 无法保证R0切除,特别是对4R区淋巴结的彻底清扫在技术上几乎不可能。③ 围手术期并发症(如支气管胸膜瘘、ARDS、感染)风险显著增加。手术在此类患者中的角色仅限于诊断(如怀疑第二原发癌或非肿瘤性病变时行活检)或处理并发症(如保守治疗无效的咯血或肺脓肿引流)。当前治疗应优先考虑非手术的局部治疗手段(如再程放疗)联合全身治疗。
瘤内科:患者既往对两种化疗方案(紫杉醇/铂类、依托泊苷/铂类)敏感,但首次化疗耐受性极差。目前复发距末次治疗约9个月,理论上仍可能对铂类敏感,但考虑到既往严重毒性史,再次使用强烈双药化疗需极其谨慎。首选推荐进行免疫治疗。若经济条件允许,应尝试获取组织或血液进行PD-L1及肿瘤突变负荷(TMB)检测以指导决策。若无法检测或表达阴性,可考虑免疫联合化疗(需在PS评分良好前提下)。若患者坚决拒绝或无法承担免疫治疗,可考虑单药化疗或参加新药临床试验。
放疗科:患者为孤立性局部复发(原发灶进展),且既往对放疗敏感(淋巴结持续控制),这是考虑再程放疗的最重要指征。提供局部根治性机会是可能延长生存、控制症状的唯一手段。核心限制因素是正常组织的耐受剂量,特别是脊髓、正常肺组织、邻近大血管。首次放疗已给予这些器官接近耐受极限的剂量。再程放疗将显著增加不可逆、致命性毒性的风险如放射性脊髓炎、放射性肺炎、主动脉损伤。通过适形调强放疗(IMRT) 技术,利用影像引导(IGRT)实现毫米级精度,紧紧包裹肿瘤(GTV),并产生极其陡峭的剂量跌落梯度,以最大限度地保护周围危及器官(OARs)。结合患者先前同步放化疗耐受良好,病人PS评分1分,较年轻,可以给与同步放化疗治疗,争取治愈可能。
讨论意见
首先对首次放疗计划数据进行剂量叠加评估,若评估后认为风险可控,与患者及家属深入沟通后,针对复发的原发灶行再程同步放化疗。若再程放疗风险过高或患者拒绝,则以全身治疗为主,首选免疫治疗±化疗。
治疗经过
经过评估上次放疗计划主要危及器官受量(脊髓:max≤43.56Gy; 双肺:V20≤20%,V5≤35%;主动脉max≤55Gy)结合本次放疗的照射范围,患者可以承受再程放疗获得治愈的机会。与患者及家属深入沟通后,家人愿意承担放射性脊髓炎、放射性肺炎、主动脉损伤等风险,接受同步放化疗方案。
患者于2021-09-06开始放疗,肿瘤区(GTV)剂量PTV6G/30次,计划靶区(PTV)、亚临床病灶(CTV)剂量50Gy/25次,脊髓:max≤10Gy; 双肺:V20≤5%;主动脉max≤63Gy(图6)。期间完成2周期EP方案化疗(依托泊苷150ng d1-3+顺铂40mgd1-3),2021.10.20放疗结束。
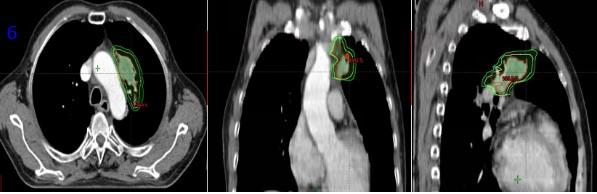
图6 放疗靶区范围(红线GTV,黄线CTV,绿线PTV)
放疗结束后建议患者使用PDL-1抑制剂度伐利尤单抗免疫巩固治疗,该药价格昂贵,家属拒绝。后通过查阅文献,根据LUN14-179研究PD-1抑制剂免疫巩固治疗获益明显。建议使用国产PD-1抑制卡瑞利珠单抗治疗。患者于2021年10月16日-2022年8月1日完成10周期卡瑞利珠单抗200mg免疫治疗,后患者因皮肤毛细血管增生更换信迪力单抗治疗。2022年9月14日-2024年5月2日完成12周期信迪利单抗200mg抗肿瘤免疫治疗,期间未出现明显不良反应。2024年5月免疫治疗后,后期定期随访复查,最后一次随访时间2025年4月15日,胸部CT未发现肿瘤。
随访观察
2022年3月15日再程放疗后5个月复查胸部CT可见肿瘤较前缩小(图7),RECIST评价PR。
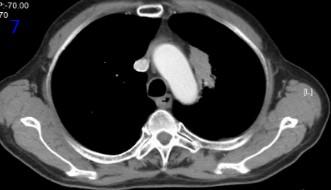
图7再程放疗后胸部CT
2022年10月18日再程放疗后12个月复查胸部CT可见肿瘤较前缩小(图8),RECIST评价PR。
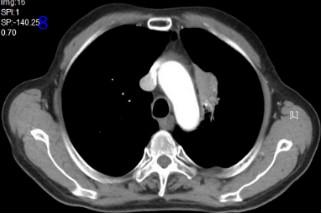
图8再程放疗后12个月胸部CT
2023年12月26日再程放疗后24个月复查胸部CT可见肿瘤明显缩小(图9),RECIST评价PR。2024年2月18日、2024年12月22日、2025年4月15日在外院行胸部CT提示“左肺上叶及纵隔旁见斑片条索阴影,考虑增值性病灶”。2025年8月20日电话随访,患者正常生活,未诉任何不适。患者再程放疗后4年8个月,病情稳定,总生存超过5年,达到临床治愈效果。
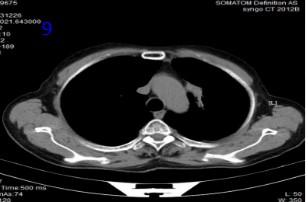
图9 再程放疗后24个月胸部CT
讨论
1.再程放疗的决策与技术实施:风险与获益的精准平衡
对于首程放疗后野内孤立复发,再程放疗是潜在根治手段,但其核心挑战在于危及器官(OARs)的累积辐射剂量[3]。本例决策的关键在于对历史放疗计划的精确剂量学分析。数据显示,首程放疗后脊髓最大点剂量(Dmax)≤43.56 Gy,双肺V20≤20%,主动脉Dmax≤55 Gy。基于此,再程放疗计划设定了极为严格的约束:脊髓Dmax增量≤10 Gy(总累积剂量≤53.56 Gy,低于54 Gy的常规耐受阈值)[4];双肺V20增量≤5%(总V20≤25%);主动脉虽累积剂量达63 Gy,但考虑到其耐受性相对较高,在严密监控下属于可接受范围[5]。采用容积旋转调强放疗(VMAT)技术确保了高剂量区与靶区的高度适形和陡峭的剂量跌落,是安全实施的技术保障[6]。与患者及家属就放射性脊髓炎、肺炎、大出血等风险进行充分知情同意是伦理上的必要步骤。
2.国产PD-1抑制剂作为巩固治疗的依据与可行性
尽管PACIFIC方案是标准,但经济因素常成为障碍。本例选用国产PD-1抑制剂是基于坚实的理论和实践依据。首先,放疗可通过诱导免疫原性细胞死亡、释放肿瘤抗原等方式激活全身免疫应答,与PD-1抑制剂具有显著的协同作用[7]。在再程放疗极大降低肿瘤负荷后,启用免疫治疗可高效清除残余病灶和微转移灶,是实现长期控制的关键。其次,国产PD-1抑制剂(如卡瑞利珠单抗、信迪利单抗)在多项大型III期临床研究中(如CameL-sq研究[8]、ORIENT-12研究[9])已证实其一线治疗晚期肺鳞癌的疗效和安全性不劣于进口药物,且价格显著降低,医保覆盖提高了可及性。本例中及时处理卡瑞利珠单抗相关的反应性皮肤毛细血管增生症(RCCEP)[10]并换用信迪利单抗,体现了对免疫相关不良反应(irAEs)的良好管理,保障了治疗的长期维持。
结论
本案例成功证明,通过MDT模式,为经过严格选择的局部复发肺癌患者实施精准的再程放疗,并在其后采用国产PD-1抑制剂进行巩固维持治疗,是一种能够带来深度、持久缓解且兼顾成本效益的个体化综合治疗策略。这为无法承担标准进口免疫药物治疗的患者提供了重要的替代方案和希望,值得在临床实践中进一步探索和验证。
参考文献
[1] Rulach R, et al. An international expert survey on the indications and practice of radical thoracic re-irradiation for non-small cell lung cancer. Clin Transl Radiat Oncol. 2023;40:100610.
[2] Antonia SJ, et al. Durvalumab after Chemoradiotherapy in Stage III Non-Small-Cell Lung Cancer: 5-Year Survival Outcomes From the PACIFIC Trial. J Clin Oncol. 2024;42(18):2143-2152.
[3] Higgins KA, et al. NRG Oncology/RTOG 1308: Phase III Trial Comparing Overall Survival After Photon Versus Proton Chemoradiotherapy for Inoperable Stage II-IIIB NSCLC. J Clin Oncol. 2024;42(14):1635-1644.
[4] Guckenberger M, et al. ESTRO ACROP guidelines for target volume definition in the treatment of locally advanced non-small cell lung cancer. Radiother Oncol. 2023;178:109458.
[5] Rim CH, et al. A systematic review and meta-analysis of thoracic re-irradiation for locoregionally recurrent non-small cell lung cancer. Lung Cancer. 2022;173:100-110.
[6] Peters S, et al. 5-Year Update from KEYNOTE-189: Pembrolizumab Plus Pemetrexed and Platinum Versus Placebo Plus Pemetrexed and Platinum for Previously Untreated Metastatic Nonsquamous Non-Small-Cell Lung Cancer. J Clin Oncol. 2024;42(18):2112-2124.
[7] Wang J, et al. Final Progression-Free Survival Analysis of CameL-sq: Camrelizumab Plus Carboplatin and Paclitaxel as First-Line Therapy for Advanced Squamous NSCLC. J Thorac Oncol. 2023;18(9):1170-1183.
[8] Lu S, et al. Overall Survival with Sintilimab Plus Chemotherapy in Previously Untreated Advanced Squamous NSCLC: Final Analysis of the Phase 3 ORIENT-12 Study. J Thorac Oncol. 2024;19(3):426-437.
[9] Faivre-Finn C, et al. Durvalumab after Chemoradiotherapy in Unresectable Stage III NSCLC: 7-Year Follow-Up and the Impact of PACIFIC-6. Lung Cancer. 2024;191:107784.
[10] McDonald F, et al. Re-irradiation with modern techniques in non-small cell lung cancer: a systematic review and meta-analysis by the Advanced Radiation Technology Committee of the ESTRO. Lung Cancer. 2024;193:107832.
病史资料
男性,61岁 ,因“确诊左肺癌4月余,痰中带血3天”入院。患者于2020年6月30日因"咳嗽、咳痰"在家人陪同下前往滕州某医院行健康查体,行胸部CT提示左肺上叶占位性病变,左肺门及纵隔4R区可见肿大淋巴结(图1)。2020年7月3日行CT引导下肺穿刺活检,病理检查示:(左肺穿刺活检)分化差的癌,结合免疫组化结果考虑鳞状细胞癌。免疫组化示:CK广(+) CK5/6(+), P40(+),TF-1(-),CX7(-),CD56(-), NapsinA(-),CgA(-),Syn(-),Ki67(约50%阳性)。2020年7月-10月在外院完成“(白蛋白型)紫杉醇300mg,d1+洛铂50mg,d1”化疗3个周期,2020年10月20日复查胸部CT,肿瘤较前缩小,疗效评价PR(图2),患者因IV度骨髓抑制,严重乏力、纳差未在继续化疗。近3日患者出现咳嗽,痰中带血3天,病人为求进一步治疗到我院就诊,门诊以“左肺癌”收入院。患者吸烟20年,20支/日,偶尔饮酒。既往史、婚育史、家族史无特殊。
体格检查:BP :135/80mmHg,P:85次/分,R:22次/分,T:36.5℃,H158 cm,W 60kg,BS 1.71,ECOG 1分。两肺呼吸音粗,未闻及干湿啰音。心率85次/分,律齐,未闻及病理性杂音。腹软,肝脾肋下未及,移动性浊音(-)。
辅助检查:肝功、肾功、血离子、血常规、血凝、尿常规、心电图、颈部超声、肝胆胰脾超声、颅脑MR未见异常,胸部CT见图1-2。

图1胸部CT:左肺肿瘤及肿大淋巴结

图2 胸部CT可见肿瘤经化疗后减小
初步诊断:左肺鳞癌,cT3N3M0,IIIC期,纵膈淋巴结转(4R区),肺门淋巴结转移移
第一次MDT讨论与治疗情况
讨论情况
病理科意见:患者病理报告,(左肺穿刺)组织镜下为分化差的癌。免疫组化染色结果显示:CKpan(+)、CK5/6(+)、P40(+),此三联标记强阳性高度支持鳞状细胞癌的诊断。同时,甲状腺转录因子-1(TTF-1)、NapsinA阴性有效排除了肺腺癌;CD56、CgA、Syn阴性排除了神经内分泌肿瘤。Ki-67增殖指数约50%,提示肿瘤增殖活性较高,符合鳞癌生物学特性。目前无进行PD-L1表达检测的信息,若后续考虑免疫治疗,建议尽可能补测PD-L1表达水平,为治疗决策提供更多依据。
影像科:患者2020年6月基线胸部CT提示左肺上叶中央型肿块,符合原发性肺癌影像学表现。同时存在左肺门及4R组淋巴结肿大,最大短径均超过1cm,考虑淋巴结转移。根据第8版肺癌TNM分期,4R区淋巴结转移归类为N3。如病人条件允许,可行PET-CT检查,PET-CT能全面评估全身代谢情况,精确判断纵隔淋巴结(N3)的活性,并明确有无其他潜在的远处转移灶(M1),这对于IIIC期患者的分期确认和放疗靶区勾画至关重要。
胸外科:患者临床分期为cT3N3M0 IIIC期。根据目前国际指南,同侧纵隔对侧(4R区属于上纵隔,相对于左肺原发灶,可视为对侧纵隔)的N3淋巴结转移属于绝对不可切除范畴。强行手术无法达到R0切除,预后极差,且不能带来生存获益。因此不建议行根治性手术治疗。外科在本患者治疗中的角色有限,可能仅限于诊断性穿刺或未来若出现并发症(如大咯血不止)时的姑息性干预。当前治疗应以内科和放疗科为主导。
肿瘤内科:患者对“白蛋白紫杉醇+洛铂”方案化疗敏感(达到PR),但耐受性极差,出现了IV度骨髓抑制,导致治疗中断。这表明患者体能状态(PS)和骨髓储备功能较差,尽行下一周期化疗可考虑更换骨髓抑制较轻的药物。患者目前分期cT3N3M0,有时常规影像检查不能发现远处转移灶,建议行PET-CT检查进行全面的分期。患者目前PD-L1表达不知,建议补充PD-L1检查,指导后续免疫治疗。若该患者排除远处转移,首选同步放化疗,备选序贯放化疗;如患者拒绝强烈化疗,可根据PD-L1表达选择免疫治疗或单纯放疗;若检查发现远处转移,则转为姑息性全身治疗为主。
放疗科:对于IIIC期不可切除的NSCLC,根治性同步放化疗是标准治疗方案。患者化疗有效但因毒性中断,放疗是提供局部根治性机会的最重要手段。患者前期化疗有效,目前患者痰中带血提示肿瘤可能再次活动,放疗对止血有良好效果。应在患者身体状况允许的情况下,尽快启动根治性放疗。放疗靶区需覆盖左肺上叶原发灶、受累的肺门淋巴结及4R区纵隔淋巴结。采用适形调强放疗(IMRT) 技术,以保护脊髓、食管、心脏、正常肺组织(尤其是右肺),最大限度地降低放射性肺炎、食管炎等风险。根治性剂量通常为60-66Gy/30-33次。考虑患者刚刚发生的IV度骨髓抑制史,化疗药物可选择骨髓抑制较轻的依托泊苷和顺铂。放疗结束后,若疾病得到控制,可根据PD-L1表达情况,考虑使用度伐利尤单抗(I药)进行巩固免疫治疗(基于PACIFIC研究模式),以进一步延长生存。
讨论意见
1.如患者条件允许进一步全身PET-CT,进行精确的再分期和放疗靶区规划。同时,设法检测肿瘤组织PD-L1表达。
2.若全身评估仍确认为IIIC期(无远处转移),首选:根治性同步放化疗,化疗方案选择EP方案, 需要与患者及家属充分沟通获益与风险(尤其是血液学及食管毒性)。 若患者拒绝化疗,则行根治性放疗(如60-66Gy/30-33f)。若全身评估发现远处转移(M1),则治疗目标转为姑息治疗。
治疗情况
经与患者及家属沟通,病人因经济条件限制,暂时不进行PET-C和PD-L1检测,接受同步放疗。患者于2020年10月21日开始同步放化疗,期间完成2周期EP方案化疗(依托泊苷150mgd1-3+顺铂40mgd1-3),左肺肿瘤及转移淋巴结完成放疗总量60Gy/30次,4R、4L、5区、6区、肺门淋巴引流区及亚临床病灶完成放疗剂量50Gy/25次,脊髓:max≤43.56Gy; 双肺:mean ≤15Gy,V20≤20%,V5≤35%;心脏:V30≤3%,;2020年11月31日顺利结束。治疗结束后建议病人使用度伐利尤单抗维持治疗,因经济受限未使用,后续进入随访观察。
观察随访
2020年12月29日,放疗后1个月复查胸部CT可见肿瘤及转移淋巴结较前缩小(图3),RECIST评价,PR。

图3 放疗后1月胸部CT
2021年3月19日,放疗后3个月,因胸闷、憋喘复查胸部CT可见双肺炎性病变,肿瘤继续缩小(图4),考虑放射性肺炎给与甲泼尼龙对症治疗好转。

图4 放疗后3个月胸部CT
2021年8月30日,放疗后9个月,胸部CT可见左肺肿瘤较2021年3月19日明显增大(图5), RECIST评价,PD。

图5放疗后9个月胸部CT
第二次MDT讨论与治疗情况
讨论情况
胸外科:患者为放疗后局部复发,且仍伴有N3淋巴结(4R区)转移。这种情况属于非常晚期的局部区域性疾病。手术面临巨大挑战:① 放疗后组织纤维化、粘连严重,解剖层次不清,手术难度极高,出血风险大。② 无法保证R0切除,特别是对4R区淋巴结的彻底清扫在技术上几乎不可能。③ 围手术期并发症(如支气管胸膜瘘、ARDS、感染)风险显著增加。手术在此类患者中的角色仅限于诊断(如怀疑第二原发癌或非肿瘤性病变时行活检)或处理并发症(如保守治疗无效的咯血或肺脓肿引流)。当前治疗应优先考虑非手术的局部治疗手段(如再程放疗)联合全身治疗。
瘤内科:患者既往对两种化疗方案(紫杉醇/铂类、依托泊苷/铂类)敏感,但首次化疗耐受性极差。目前复发距末次治疗约9个月,理论上仍可能对铂类敏感,但考虑到既往严重毒性史,再次使用强烈双药化疗需极其谨慎。首选推荐进行免疫治疗。若经济条件允许,应尝试获取组织或血液进行PD-L1及肿瘤突变负荷(TMB)检测以指导决策。若无法检测或表达阴性,可考虑免疫联合化疗(需在PS评分良好前提下)。若患者坚决拒绝或无法承担免疫治疗,可考虑单药化疗或参加新药临床试验。
放疗科:患者为孤立性局部复发(原发灶进展),且既往对放疗敏感(淋巴结持续控制),这是考虑再程放疗的最重要指征。提供局部根治性机会是可能延长生存、控制症状的唯一手段。核心限制因素是正常组织的耐受剂量,特别是脊髓、正常肺组织、邻近大血管。首次放疗已给予这些器官接近耐受极限的剂量。再程放疗将显著增加不可逆、致命性毒性的风险如放射性脊髓炎、放射性肺炎、主动脉损伤。通过适形调强放疗(IMRT) 技术,利用影像引导(IGRT)实现毫米级精度,紧紧包裹肿瘤(GTV),并产生极其陡峭的剂量跌落梯度,以最大限度地保护周围危及器官(OARs)。结合患者先前同步放化疗耐受良好,病人PS评分1分,较年轻,可以给与同步放化疗治疗,争取治愈可能。
讨论意见
首先对首次放疗计划数据进行剂量叠加评估,若评估后认为风险可控,与患者及家属深入沟通后,针对复发的原发灶行再程同步放化疗。若再程放疗风险过高或患者拒绝,则以全身治疗为主,首选免疫治疗±化疗。
治疗经过
经过评估上次放疗计划主要危及器官受量(脊髓:max≤43.56Gy; 双肺:V20≤20%,V5≤35%;主动脉max≤55Gy)结合本次放疗的照射范围,患者可以承受再程放疗获得治愈的机会。与患者及家属深入沟通后,家人愿意承担放射性脊髓炎、放射性肺炎、主动脉损伤等风险,接受同步放化疗方案。
患者于2021-09-06开始放疗,肿瘤区(GTV)剂量PTV6G/30次,计划靶区(PTV)、亚临床病灶(CTV)剂量50Gy/25次,脊髓:max≤10Gy; 双肺:V20≤5%;主动脉max≤63Gy(图6)。期间完成2周期EP方案化疗(依托泊苷150ng d1-3+顺铂40mgd1-3),2021.10.20放疗结束。

图6 放疗靶区范围(红线GTV,黄线CTV,绿线PTV)
放疗结束后建议患者使用PDL-1抑制剂度伐利尤单抗免疫巩固治疗,该药价格昂贵,家属拒绝。后通过查阅文献,根据LUN14-179研究PD-1抑制剂免疫巩固治疗获益明显。建议使用国产PD-1抑制卡瑞利珠单抗治疗。患者于2021年10月16日-2022年8月1日完成10周期卡瑞利珠单抗200mg免疫治疗,后患者因皮肤毛细血管增生更换信迪力单抗治疗。2022年9月14日-2024年5月2日完成12周期信迪利单抗200mg抗肿瘤免疫治疗,期间未出现明显不良反应。2024年5月免疫治疗后,后期定期随访复查,最后一次随访时间2025年4月15日,胸部CT未发现肿瘤。
随访观察
2022年3月15日再程放疗后5个月复查胸部CT可见肿瘤较前缩小(图7),RECIST评价PR。

图7再程放疗后胸部CT
2022年10月18日再程放疗后12个月复查胸部CT可见肿瘤较前缩小(图8),RECIST评价PR。

图8再程放疗后12个月胸部CT
2023年12月26日再程放疗后24个月复查胸部CT可见肿瘤明显缩小(图9),RECIST评价PR。2024年2月18日、2024年12月22日、2025年4月15日在外院行胸部CT提示“左肺上叶及纵隔旁见斑片条索阴影,考虑增值性病灶”。2025年8月20日电话随访,患者正常生活,未诉任何不适。患者再程放疗后4年8个月,病情稳定,总生存超过5年,达到临床治愈效果。

图9 再程放疗后24个月胸部CT
讨论
1.再程放疗的决策与技术实施:风险与获益的精准平衡
对于首程放疗后野内孤立复发,再程放疗是潜在根治手段,但其核心挑战在于危及器官(OARs)的累积辐射剂量[3]。本例决策的关键在于对历史放疗计划的精确剂量学分析。数据显示,首程放疗后脊髓最大点剂量(Dmax)≤43.56 Gy,双肺V20≤20%,主动脉Dmax≤55 Gy。基于此,再程放疗计划设定了极为严格的约束:脊髓Dmax增量≤10 Gy(总累积剂量≤53.56 Gy,低于54 Gy的常规耐受阈值)[4];双肺V20增量≤5%(总V20≤25%);主动脉虽累积剂量达63 Gy,但考虑到其耐受性相对较高,在严密监控下属于可接受范围[5]。采用容积旋转调强放疗(VMAT)技术确保了高剂量区与靶区的高度适形和陡峭的剂量跌落,是安全实施的技术保障[6]。与患者及家属就放射性脊髓炎、肺炎、大出血等风险进行充分知情同意是伦理上的必要步骤。
2.国产PD-1抑制剂作为巩固治疗的依据与可行性
尽管PACIFIC方案是标准,但经济因素常成为障碍。本例选用国产PD-1抑制剂是基于坚实的理论和实践依据。首先,放疗可通过诱导免疫原性细胞死亡、释放肿瘤抗原等方式激活全身免疫应答,与PD-1抑制剂具有显著的协同作用[7]。在再程放疗极大降低肿瘤负荷后,启用免疫治疗可高效清除残余病灶和微转移灶,是实现长期控制的关键。其次,国产PD-1抑制剂(如卡瑞利珠单抗、信迪利单抗)在多项大型III期临床研究中(如CameL-sq研究[8]、ORIENT-12研究[9])已证实其一线治疗晚期肺鳞癌的疗效和安全性不劣于进口药物,且价格显著降低,医保覆盖提高了可及性。本例中及时处理卡瑞利珠单抗相关的反应性皮肤毛细血管增生症(RCCEP)[10]并换用信迪利单抗,体现了对免疫相关不良反应(irAEs)的良好管理,保障了治疗的长期维持。
结论
本案例成功证明,通过MDT模式,为经过严格选择的局部复发肺癌患者实施精准的再程放疗,并在其后采用国产PD-1抑制剂进行巩固维持治疗,是一种能够带来深度、持久缓解且兼顾成本效益的个体化综合治疗策略。这为无法承担标准进口免疫药物治疗的患者提供了重要的替代方案和希望,值得在临床实践中进一步探索和验证。
参考文献
[1] Rulach R, et al. An international expert survey on the indications and practice of radical thoracic re-irradiation for non-small cell lung cancer. Clin Transl Radiat Oncol. 2023;40:100610.
[2] Antonia SJ, et al. Durvalumab after Chemoradiotherapy in Stage III Non-Small-Cell Lung Cancer: 5-Year Survival Outcomes From the PACIFIC Trial. J Clin Oncol. 2024;42(18):2143-2152.
[3] Higgins KA, et al. NRG Oncology/RTOG 1308: Phase III Trial Comparing Overall Survival After Photon Versus Proton Chemoradiotherapy for Inoperable Stage II-IIIB NSCLC. J Clin Oncol. 2024;42(14):1635-1644.
[4] Guckenberger M, et al. ESTRO ACROP guidelines for target volume definition in the treatment of locally advanced non-small cell lung cancer. Radiother Oncol. 2023;178:109458.
[5] Rim CH, et al. A systematic review and meta-analysis of thoracic re-irradiation for locoregionally recurrent non-small cell lung cancer. Lung Cancer. 2022;173:100-110.
[6] Peters S, et al. 5-Year Update from KEYNOTE-189: Pembrolizumab Plus Pemetrexed and Platinum Versus Placebo Plus Pemetrexed and Platinum for Previously Untreated Metastatic Nonsquamous Non-Small-Cell Lung Cancer. J Clin Oncol. 2024;42(18):2112-2124.
[7] Wang J, et al. Final Progression-Free Survival Analysis of CameL-sq: Camrelizumab Plus Carboplatin and Paclitaxel as First-Line Therapy for Advanced Squamous NSCLC. J Thorac Oncol. 2023;18(9):1170-1183.
[8] Lu S, et al. Overall Survival with Sintilimab Plus Chemotherapy in Previously Untreated Advanced Squamous NSCLC: Final Analysis of the Phase 3 ORIENT-12 Study. J Thorac Oncol. 2024;19(3):426-437.
[9] Faivre-Finn C, et al. Durvalumab after Chemoradiotherapy in Unresectable Stage III NSCLC: 7-Year Follow-Up and the Impact of PACIFIC-6. Lung Cancer. 2024;191:107784.
[10] McDonald F, et al. Re-irradiation with modern techniques in non-small cell lung cancer: a systematic review and meta-analysis by the Advanced Radiation Technology Committee of the ESTRO. Lung Cancer. 2024;193:107832.
版权声明:
本站所注明来源为"爱爱医"的文章,版权归作者与本站共同所有,非经授权不得转载。
本站所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们
联系zlzs@120.net,我们将立即进行删除处理
本站所注明来源为"爱爱医"的文章,版权归作者与本站共同所有,非经授权不得转载。
本站所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们
联系zlzs@120.net,我们将立即进行删除处理

