晶格放射治疗有效治疗大块肺肉瘤样癌1例
在姑息治疗方面对于无法切除的大块肿瘤的管理一直是一个难题。晚期癌症患者由于肿瘤造成的器官压迫和浸润,因此承受着巨大的痛苦。患者通常身体比较虚弱,因此治疗策略应尽可能保守,主要以缓解症状、提高生活质量以及避免过度毒性为主[1]。
考虑到全身治疗联合常规放疗在巨大肿瘤患者中的效果不佳,体部立体定向放疗(stereotactic body radiotherapy,SBRT)是一种可以尝试的新选择。然而,SBRT通常在1-5次分割中给予高剂量,仅用于较小的病变(最大直径 5 厘米),以避免严重毒性反应[2]。标准的姑息性照射采用低剂量即 20 Gy/5 次分割或 30 Gy/10 次分割,无法对大肿瘤实现令人满意的控制。在此背景下,晶格放射治疗(Lattice radiation therapy,LRT)可能是一种很有前景的策略,通过给予极高剂量的辐射来提高疗效,同时不会增加危及器官(organs at risk,OAR)的毒性。
LRT 是一种空间分割放射治疗(SFRT)技术,其基于在靶区形成非均匀剂量分布同时保护危及器官[3]。它由二维网格治疗的三维体积配置构成,基于在靶区病灶内部创建的三维阵列。该阵列存在高剂量区域,称为“峰”剂量,其间由周边低剂量区域即“谷”剂量隔开[4,5]。该技术能够给予肿瘤消融剂量,增加了肿瘤缩小的概率,并带来持久的疗效。此外,治疗肿瘤体积内产生的不均匀剂量梯度可能改善免疫系统对未受照射部位肿瘤细胞的应答[6,7]。下文我们展示了1例LRT治疗不可切除肺肉瘤样癌案例,并对其进行了讨论。
病例报告
患者男,69岁,2023 年 5 月因骶骨疼痛和呼吸困难入院。入院后行胸部CT检查发现骶髂关节3.8 cm×3.8 cm肿物以及肺部大肿块,直径11 cm×12 cm,该肿块环绕并明显压迫左主支气管,双侧肺门和纵隔多处肿大淋巴结,见图1。后行支气管内超声引导下经支气管针吸活检(EBUS-TBNA)获取病理组织用于细胞学、免疫组化和肿瘤比例评分(TPS)检测。病理结果为肺肉瘤样癌,免疫组化结果:CK-Pan(+),EMA(+),TTF-1(-),NapsinA(-),P40(-),Bcl-2(-),CD34 (-) , WT1(-), CK5/6(-),Calretinin(-),MC(-),CK19 (+).PD-L1 TPS>50%。肿瘤分期为cT4N3M1c,IV 期。
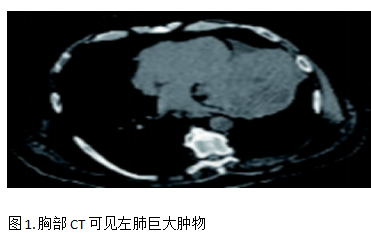
为了缓解骶骨疼痛,骶骨接受姑息性放疗,剂量为20Gy/5次,止痛效果良好且病灶稳定。2023年5月-10月完成6个周期的卡铂+紫杉醇化疗。2023年12月复查胸部CT发现原发灶和纵隔淋巴结进展(PD),二线治疗方案改用纳武利尤单抗免疫治疗,2024年1月-3月完成6个周期免疫治疗,2024年4月复查胸部CT发现疾病再次进展(PD),见图2。
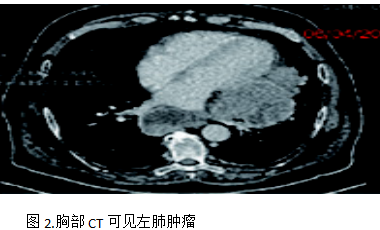
病人开始三线治疗,2024年4月-9月完成6周期吉西他滨联合卡铂化疗。后患者出现呼吸困难加重,ECOG 2 分,于2024 年 9 月复查胸部CT,显示肺部肿瘤直径19 cm×16 cm,疾病进一步进展(PD)。
考虑到肿瘤巨大,经MDT讨论后采用LRT而非标准姑息性放疗,并经过患者同意。2024年9月10日至20日,患者接受了LRT治疗,在肿瘤内部顶点剂量给予55Gy/5次,病灶周边剂量为20Gy/5次。
患者定位时,使用体膜固定,大孔径CT扫描,层厚3mm。从定位CT采集到首次治疗的时间间隔为3天。在放疗计划制定方面,我们使用Eclipse 15.6版计划系统(TPS)以及 AAA 算法。能量选用6MV无均整滤过器的X射线,适形调强放疗技术(IMRT)进行计划设计,共应用13个射野,应用Varian直线加速器IX进行图像引导(IGRT)照射,1次/日,共5次。每天通过锥形束CT对患者的摆位进行验证。患者在治疗床上的平均时间为 20 分钟。
参照Lattice框架,在轴向平面内顶点间距为3cm,正交轴上顶点中心到中心的距离为6cm(边到边距离为4.5cm),沿对角线轴的距离为 3√2 cm(空间距离)。我们参考了S.Luis 的经验,并按照 LITE SABR M1 试验中的方式放置顶点[8]。GTV是指影像学可见肿瘤及转移淋巴结。在创建晶格框架时,顶点必须距离任何危及器官(OARs)至少1.5厘米。我们在肿瘤内生成17个顶点(顶点直径=1.5 厘米),总体积为 26.5 cc。考虑到器官运动或摆位误差导致患者的位置变化,在GTV外侧各向外扩8mm生成计划靶区(PTV)。处方剂量给予95% PTV剂量20Gy/5次,同时17个顶点剂量同步增强,在顶点区域实现55Gy/5次高剂量,见图3,危及器官受量如下,双肺:V5=77.6%、V10=18.7%、V20=1.3%、Dmean =9.1 Gy;心脏:V5= 99.8%、 V10=77.9%、V20 =12.6%、Dmean=14 Gy;脊髓:Dmax =16.9 Gy;食管:Dmean=10.6 Gy; Dmax=24.9 Gy。
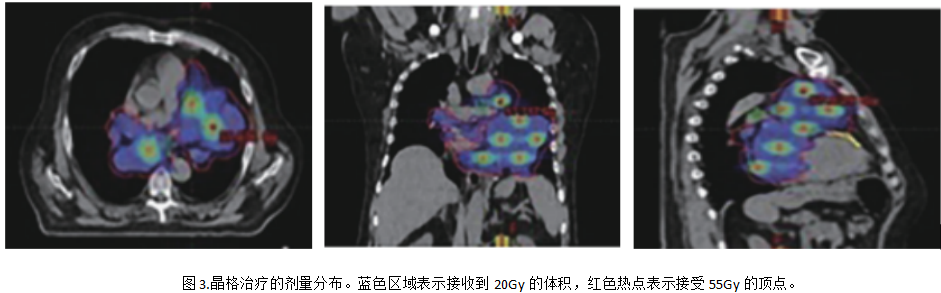
LRT治疗期间未使用化疗药物,期间患者出现1级乏力和1级食管炎,经对症治疗后缓解。LRT结束后,四线治疗给与长春瑞滨单药化疗。
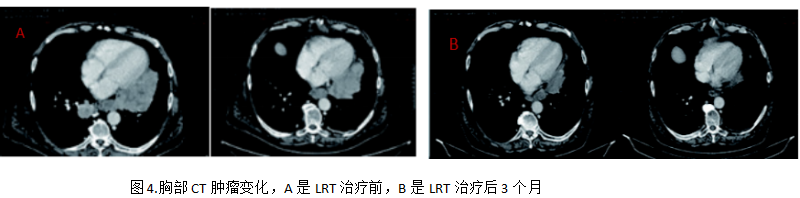
LRT治疗后前1个月,每周进行评估1次,后2个月每月接受一次评估,未报告有不良反应。2025年1月在LRT治疗后3个月时复查胸部 CT 显示原发灶(直径 8 厘米×4 厘米)和纵隔淋巴结出现了显著缩小,见图4。患者ECOG 评分1分,日常生活有了显著改善。截至 2025年4月15日的最后一次随访,ECOG1分,LRT治疗6 个月后复查胸部CT证实疾病稳定,肺部病灶的缓解状态得以持续。患者仍在继续使用长春瑞滨治疗。
讨论
体积较大的肿瘤往往具有异常的血管,内部存在坏死和缺氧区域。化疗药物无法在肿瘤内部达到足够的血药浓度,因而会大大降低化疗的效果。此外,这种大块肿瘤具有典型的免疫抑制微环境,降低机体的免疫系统活性,从而削弱免疫治疗的疗效[9,10]。尽管姑息性放疗是一种比较合适的选择,但面对体积较大的肿瘤,由于其大小及乏氧环境进而对放疗产生抵抗性。而且使用标准姑息放疗方案在不造成无法接受的毒性风险情况下难以达到有效的高剂量。这种以提高患者生活质量及控制症状为目的姑息治疗效果有限[11]。LRT能够在肿瘤内部给予高剂量同时在肿瘤周边保持较低剂量,并有可能在可接受的毒性范围内实现肿瘤缓解。
有关LRT的研究介绍
尽管LRT具有治疗潜力,但目前关于治疗计划和患者预后的相关数据较少。此外,许多现有病例多采用的是混合或非单纯纯LRT方法[12,13]。例如,Amendola 等人报道了一组关于非小细胞肺癌(NSCLC)的 LRT治疗病例,肿瘤体积缩小约 40%。然而,他们采用的是混合方法,首次LRT治疗(顶点 18 Gy,周边 3 Gy)之后进行了常规放疗(25/33 次,每次1.8-2 Gy)[12]。在另一组 IIIB - IVA 期巨大宫颈癌病例中也采用了类似的混合 LRT方法,患者先接受了LTR(顶点 24 Gy,周边9 Gy,分 3 次),随后进行了常规放疗(39.60 - 45.00 Gy,每次1.8 Gy)[13]。人们比较担心在进行适当的LRT治疗时(即多分次)可能会导致放疗剂量过高,这可能是LRT临床文献匮乏的一个原因。然而,值得注意的是,最近发表的“LITE SABR M1 一期试验”[8]首次证实了LRT的安全性。在本研究中,20 例有巨大病灶的肿瘤患者接受了LRT治疗,顶点剂量为 66.70 Gy,病灶周边剂量为 20 Gy,分 5 次给予(每次分别为 13.34 Gy 和 4 Gy)。
本案例应用LRT效果显著及背后机制
为了安全起见,该病例我们谨慎地将顶点剂量限制在55Gy(每次11Gy),周边剂量限制在20 Gy(每次4Gy)。该肿瘤除了发生显著的缩小外,病人还有较好的生活质量的改善。LRT除了能够克服肿瘤细胞放射性抵抗外,一些研究还表明,LRT可能会引发肿瘤细胞的免疫原性死亡,释放出许多“损伤相关分子模式(damage associated molecular patterns,DAMPs)”,从而启动并显著增强机体免疫系统的反应[14,15]。因此,由于剂量分布不均,LRT可能同时具有消融作用(局部作用)和免疫调节作用(远位效应)[16]。因此,LRT高剂量可以明显缓解肿瘤负荷外,还能够重塑免疫抑制的肿瘤微环境,使其更具免疫原性,从而在照射部位(旁观者效应)和远处部位(远位效应)启动抗肿瘤免疫反应[17]。
该案例的局限性
鉴于此,尽管有关LRT免疫调节作用的数据尚处于初步探索阶段,且必须进行进一步的研究。尽管肿瘤反应显著,但我们的报告中存在两个局限性。首先,这是一份关于单纯LRT治疗的病例报告,其主要目的是缓解症状,而未对LRT对机体免疫系统的作用进行研究。其次,尽管LRT急性期的毒性较低,但目前由于随访时间太短,尚无该患者LRT慢性毒性的相关数据。
结论
LRT可能是一种非常有效的放疗策略,能够获得具有临床意义的肿瘤反应,从而改善患者的生活质量,且不会引起治疗相关的毒性。本病例报告提供了LRT在大块肿瘤管理中的临床价值。目前尚无数据表明单纯 LRT与混合LRT哪种策略更优。因此,所有LRT方法都应积极加以研究。
参考文献
1.Jiang L, Li X, Zhang J, et al. Combined High-Dose LATTICE Radiation Therapy and Immune Checkpoint Blockade for Advanced Bulky Tumors: The Concept and a Case Report[J]. Front Oncol. 2021,10(17):548132-548140.
2.Boyce-Fappiano D, Damron EP, Farooqi A, et al. Hypofractionated Radiation Therapy for Unresectable or Metastatic Sarcoma Lesions[J]. Adv Radiat.Oncol.2022,7(2):100913-100920.
3.Duriseti S, Kavanaugh J, Goddu S, et al. Spatially fractionated stereotactic body radiation therapy (Lattice)for large tumors[J]. Adv Radiat Oncol.2021,6(5):100639-100645.
4.Wu X, Perez NC, Zheng Y, et al. The Technical and Clinical Implementation of LATTICE Radiation Therapy (LRT)[J]. Radiat Res. 2020,194(9):737-746.
5.Asur R, Butterworth KT, Penagaricano JA, et al. High dose bystander effects in spatially fractionated radiation therapy[J]. Cancer Lett. 2015,356(6):52-57.
6.Kumari S, Mukherjee S, Sinha D, et al.Immunomodulatory Effects of Radiotherapy[J].Int J Mol Sci. 2020,21(4):8151-8158.
7.Li X, Wu D, Liu H, et al.Pulmonary sarcomatoid carcinoma: progress, treatment and expectations[J].Ther Adv Med Oncol.2020,12(14):175-182.
8.Duriseti S, Kavanaugh JA, Szymanski J, et al. LITE SABR M1: A phase I trial of Lattice stereotactic body radiotherapy for large tumors[J]. Radiother Oncol.2022,167(6):317-322.
9.Karsch-Bluman A, Feiglin A, Arbib E, et al. Tissue necrosis and its role in cancer progression[J].Oncogene.2019,38(11):1920-1935.
10. Hinshaw DC, Shevde LA. The Tumor Microenvironment Innately Modulates Cancer Progression[J].Cancer Res.2019,79(8):4557-4566.
11. O'Donovan A, Morris L. Palliative Radiation Therapy in older Adults With Cancer: Age-Related Considerations[J].Clin Oncol (R Coll Radiol).2020,32(5):766-774.
12. Amendola BE, Perez NC, Wu X, et al. Safety and Efficacy of Lattice Radiotherapy in Voluminous Non-small Cell Lung Cancer[J].Cureus.2019,11(13):4263-4270.
13. Amendola BE, Perez NC, Mayr NA, et al. Spatially Fractionated Radiation Therapy Using Lattice Radiation in Far-advanced Bulky Cervical Cancer: A Clinical and Molecular Imaging and Outcome Study[J]. Radiat Res.2020,194(8):724-736.
14. Kanagavelu S, Gupta S, Wu X, et al. In vivo effects of lattice radiation therapy on local and distant lung cancer: potential role of immunomodulation[J]. Radiat Res. 2014,182(11):149-162.
15. Jarosz-Biej M, Smolarczyk R, Cichoń T, et al. Tumor Microenvironment as A "Game Changer" in Cancer Radiotherapy[J]. Int J Mol Sci. 2019,20(7):3212-3220.
16. Ferini G, Valenti V, Tripoli A, et al. Lattice or Oxygen-Guided Radiotherapy: What If They Converge? Possible Future Directions in the Era of Immunotherapy[J]. Cancers (Basel). 2021,13(6):3290-3298.
17. Cytlak UM, Dyer DP, Honeychurch J, et al.Immunomodulation by radiotherapy in tumour control and normal tissue toxicity[J]. Nat Rev Immunol.2022,22(4):124-138.
本站所注明来源为"爱爱医"的文章,版权归作者与本站共同所有,非经授权不得转载。
本站所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们
联系zlzs@120.net,我们将立即进行删除处理
热点图文
-
3D打印与AI辅助技术在泌尿外科临床应用的意义
随着精准医学理念的深入,泌尿外科诊疗正从经验性决策向个体化精准干预转变。3...[详细]
-
外科感染抗生素治疗的降阶梯策略分析
当前数据显示,外科感染患者中约30%-40%存在初始抗生素选择不当,导致治...[详细]

