医护人员注意!国家药监局:这些药品说明书,有变化!
最新修订!涉及10类产品,46个品种。
近日,根据药品不良反应监测和安全性评价结果,国家药监局发布了10则制剂修订说明书公告,涉及白芍总苷胶囊、环磷腺苷注射剂、金乌骨通胶囊等10类产品,46个品种。
01 白芍总苷胶囊
根据药品不良反应评估结果,为进一步保障公众用药安全,国家药监局决定对白芍总苷胶囊说明书内容进行统一修订。
02 金乌骨通胶囊
根据药品不良反应监测和安全性评价结果,为进一步保障公众用药安全,国家药品监督管理局决定对金乌骨通胶囊说明书【不良反应】、【禁忌】和【注意事项】项进行统一修订。
03 全身用利巴韦林制剂
根据药品不良反应评估结果,为进一步保障公众用药安全,国家药监局决定对全身用利巴韦林制剂(包括利巴韦林氯化钠注射液、利巴韦林葡萄糖注射液、利巴韦林注射液、注射用利巴韦林、利巴韦林泡腾颗粒、利巴韦林片、利巴韦林口服溶液、利巴韦林分散片、利巴韦林含片、利巴韦林胶囊、利巴韦林颗粒)说明书内容进行统一修订。
04 含碘对比剂
根据药品不良反应评估结果,为进一步保障公众用药安全,国家药监局决定对含碘对比剂(包括泛影葡胺注射液、复方泛影葡胺注射液、碘海醇注射液、碘美普尔注射液、碘帕醇注射液、碘佛醇注射液、碘克沙醇注射液、碘普罗胺注射液、碘比醇注射液)说明书内容进行统一修订。
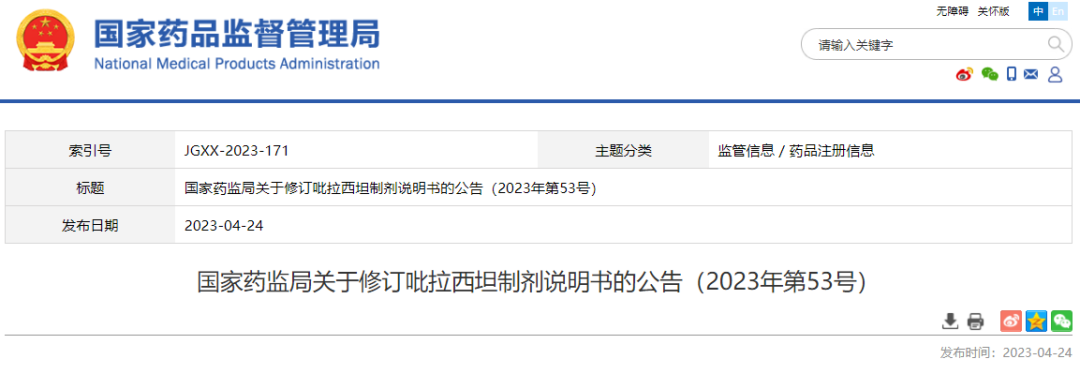
05 吡拉西坦制剂
根据药品不良反应评估结果,为进一步保障公众用药安全,国家药监局决定对吡拉西坦制剂(包括吡拉西坦分散片、吡拉西坦片、吡拉西坦胶囊、吡拉西坦颗粒、吡拉西坦口服溶液、吡拉西坦氯化钠注射液、吡拉西坦注射液、吡拉西坦葡萄糖注射液、注射用吡拉西坦)说明书内容进行统一修订。
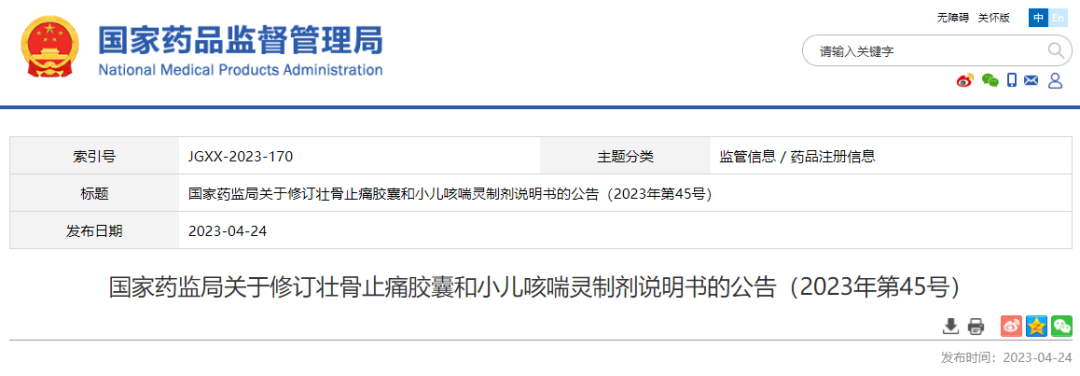
06 壮骨止痛胶囊和小儿咳喘灵制剂
根据药品不良反应监测和安全性评价结果,为进一步保障公众用药安全,国家药品监督管理局决定对壮骨止痛胶囊和小儿咳喘灵制剂说明书中的【不良反应】、【禁忌】和【注意事项】项进行统一修订。
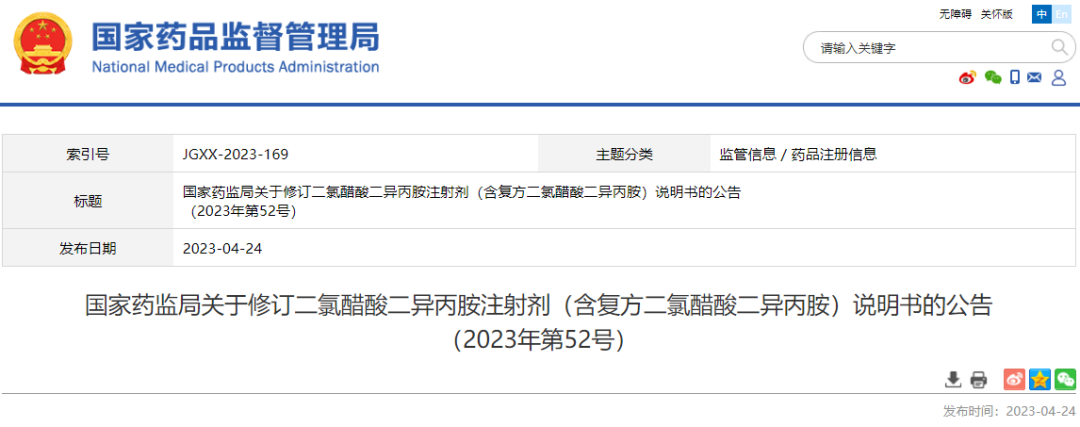
07 二氯醋酸二异丙胺注射剂
根据药品不良反应评估结果,为进一步保障公众用药安全,国家药监局决定对二氯醋酸二异丙胺注射剂(含复方二氯醋酸二异丙胺)(包括注射用二氯醋酸二异丙胺葡萄糖酸钠、复方二氯醋酸二异丙胺注射液、注射用复方二氯醋酸二异丙胺)说明书内容进行统一修订。
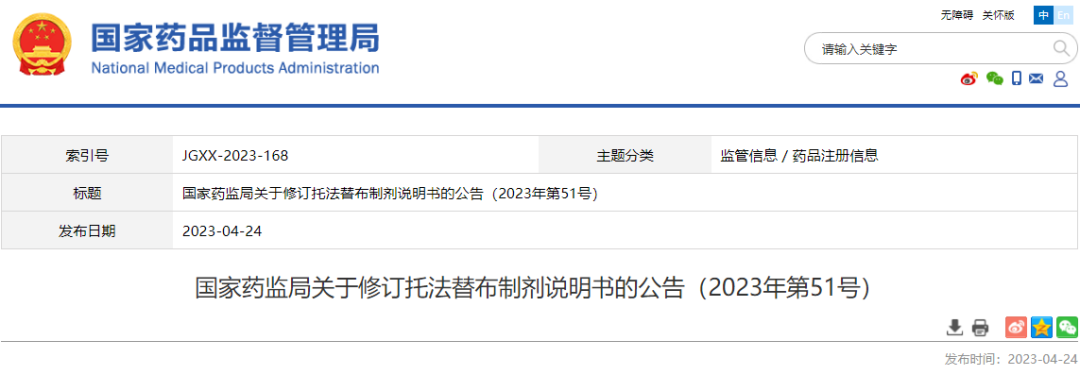
08 托法替布制剂
根据药品不良反应评估结果,为进一步保障公众用药安全,国家药监局决定对托法替布制剂(包括枸橼酸托法替布片、枸橼酸托法替布缓释片)说明书内容进行统一修订。
09 环磷腺苷注射剂
根据药品不良反应评估结果,为进一步保障公众用药安全,国家药监局决定对环磷腺苷注射剂(包括注射用环磷腺苷、环磷腺苷注射液、环磷腺苷葡萄糖注射液、环磷腺苷氯化钠注射液)说明书内容进行统一修订。
10 注射用人白介素-11
根据药品不良反应评估结果,为进一步保障公众用药安全,国家药品监督管理局决定对注射用人白介素-11【包括注射用人白介素-11、注射用重组人白介素-11、注射用重组人白介素-11(酵母)、注射用重组人白介素-11(I)】说明书内容进行统一修订。
《中国药典》2020年版已将通用名称注射用人白介素-11、注射用重组人白介素-11、注射用重组人白介素-11(酵母)合并为注射用人白介素-11,说明书修订建议适用于注射用人白介素-11和注射用重组人白介素-11(I)。
值得注意的是,临床医师、药师应当仔细阅读上述药品说明书的修订内容,在选择用药时,应当根据新修订说明书进行充分的获益/风险分析。患者用药前应当仔细阅读药品说明书,使用处方药的,应当严格遵医嘱用药。
来 源 | 国家药监局官网
版权归原作者所有,若有违规、侵权请联系我们
本站所注明来源为"爱爱医"的文章,版权归作者与本站共同所有,非经授权不得转载。
本站所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们
联系zlzs@120.net,我们将立即进行删除处理
热点图文
-
三明医生平均年薪19.56万!如何加快推进医护编制、薪酬改革?国家卫健委回应
最新!医生的平均年薪由改革前2011年的5.65万增加到2023年的19....[详细]
-
放开编制,这类医生不受限!一省发布医改重点:10项具体任务揭秘!
连续工作满15年或累计工作满25年且仍在岗的乡镇卫生院专业技术人员,在满足...[详细]

