EGFR 野生型肺癌患者免疫治疗进展后出现 EGFR 突变 1 例
非小细胞肺癌(NSCLC)发病率高,是世界上引起肿瘤相关死亡最多的癌种。如何改善 NSCLC患者的预后,延长患者的生存期是肿瘤治疗领域研究的热点之一。 自上世纪 90 年代 James P. Allison和 Tasuku Honjo 发现细胞毒性 T 淋巴细胞相关抗原4(CTLA-4)和程序性死亡受体 1(PD-1)的免疫“刹车” 机 制 以 来, 越 来 越 多 的 免 疫 检 查 点 抑 制 剂(ICIs)被应用于临床,为肿瘤患者的治疗带来了新的选择与希望。其中纳武利尤单抗是一种与PD-1 结合的全人源化 IgG4 抗体,在转移性 NSCLC的治疗中体现出良好的疗效及安全性。然而NSCLC 免疫治疗后出现耐药依然难以避免,相关耐药机制目前还未完全阐明。 本研究在临床中观测到1 例 EGFR 野生型肺腺癌患者应用纳武利尤单抗治疗显效,但在发生耐药进展后却出现 EGFR 突变的病例。 类似病例极为罕见,特报道如下。
病例资料
患者,女性,54 岁,无吸烟史及其他特殊既往史,因“咳嗽、咯痰伴左侧胸背部疼痛 2 月”于 2019年3月21日就诊。 胸部 CT 示:左肺门占位伴纵隔淋巴结肿大。 超声提示:肝脏多发占位,双侧锁骨上窝、左颈部、胸骨上窝及腹膜后多发低回声淋巴结。左锁骨上淋巴结及肝脏穿刺细胞学检查结合免疫组化,确诊为转移性肺腺癌。 肿瘤穿刺标本及血浆基因检测(NGS)均提示 EGFR、ALK 阴性。 患者诊断为:左肺腺癌( cT2N2M1c IVB 期 EGFR/ ALK 野生
型)。 遂给予患者一线化疗(培美曲塞 0. 8g d1 + 卡铂 500mg d1 q3W),4 周期后病情进展,原靶病灶部分增大,左侧肺部、肝右叶出现新发病灶,多发骨转移(图 1 ~ 4)。
2019 年 7 月 14 日予以二线化疗联合免疫治疗方案: 白蛋白紫衫醇 200mg d1 + 卡铂500mg d1 + 纳武利尤单抗治疗 100mg d2 q3W。 治疗2周期后胸痛症状缓解,2020 年 5 月 6 日 10 周期后复查 CT 见患者肺部原发病灶明显缩小,肺内及肝脏多发转移灶完全消失(图 5 ~ 8),疗效评价:部分缓解(PR)。 治疗期间仅出现轻度皮疹不良反应。此后继续给予患者纳武利尤单抗维持治疗,无进展时间达 18 个月。
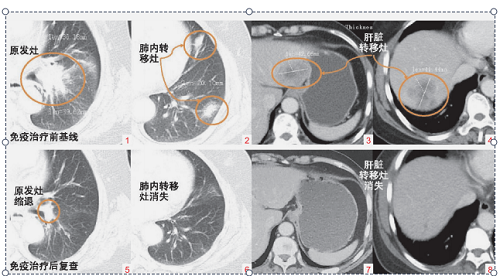
图 1 ~ 4 免疫治疗前肺部原发灶和多发转移灶 CT 基线影像(2019 年 7 月 9 日);图 5 ~ 8 免疫治疗后复查,肺脏原发病灶退缩,肺脏和肝脏多发转移性病灶消失(2020 年 5 月 6 日)
2021年1月28日患者因腹部不适查CT见盆腔包块伴腹水,考虑纳武利尤单抗耐药。 三线治疗予以盐酸安罗替尼(12mg qd d1 ~ 14 q3W)治疗 2 周期无效,病灶持续增大。 2021年4 月15日行盆腔包块穿刺活检,病理结果提示:低分化腺癌,符合肺腺癌盆腔转移,肿瘤细胞 TTF1 + ,NapsinA - ,PAX-8- ,Ki-67 约 70% + 。 盆腔病灶穿刺标本完善基因检测 ( NGS ) 提 示: EGFR Exon21 c. 2573T > Gp.L858R 突 变, 突 变 丰 度 2. 81% ; EGFR Exon21 c.2618G > Ap. G873E,突变丰度 1. 52% 。 根据检测结果,2021 年 5 月 2 日开始行四线治疗,给予患者奥
希替尼(80mg qd)口服。治疗前盆腔病灶基线大小为11. 3cm × 9. 6cm,大量胸腹水(图 9 ~ 10),2 周期奥希替尼治疗后 CT 复查见患者盆腔转移病灶退缩至 10. 0cm × 8. 0cm,胸腹水量减少(图 11 ~ 12),提示治疗有效。 但 2021 年 8 月 10 日患者病灶再次出现增大增多,无进展时间( PFS)仅维持 3. 3 月。 患者家属拒绝再次穿刺及基因检测,予以长春瑞滨 +顺铂方案行挽救性化疗2周期无效。 患者于2021年10月21日去世,总生存时间 31 月。

图 9 ~ 10 奥希替尼治疗前胸腹水和盆腔巨大转移灶 CT 检查基线影像(2021 年 4 月 30 日);图 11 ~ 12 奥希替尼治疗后胸腹水缓解,盆腔转 移灶缩小(2021 年 7 月 6 日复查)
讨 论
免疫治疗后出EGFR突变非常少见
肺癌患者接受 ICIs 治疗的耐药机制较为复杂,在免疫治疗的动态演变过程中,肿瘤细胞抗原表达缺失 及 呈 递 障 碍, 多 种 信 号 通 路 ( MAPK、 PI3K/AKT、WNT、JAK-STAT)的激活及特定基因( PTEN)的表达缺失,PD-L1 表达上调,T 细胞功能的丧失,免疫抑制细胞的增多及免疫抑制因子分泌,肠道菌群的变化等多种因素均可能导致免疫治疗出现耐药,然而 EGFR 突变作为 ICIs 耐药机制的报道并不多见,截至目前仅 Chen Xia 等人报道了一例同样在应用多个疗程纳武利尤单抗后出现病情进展,再次基因检测后发现了 EGFR 21 外显子 L858R 突变的病例。这与我们的病例较为相似,但我们的病人在长疗程的纳武单抗治疗后,不仅仅出现了EGFR L858R 突变,还出现了EGFR G873E 突变,这也是首次发现 EGFR 野生型肺癌患者免疫治疗后出现 EGFR G873E 罕见突变的报道。
EGFR突变与PD-L1表达
EGFR 基因是NSCLC 中最常见的致癌驱动基因,在亚洲人群中的突变频率约为 40%。 EGFR突变与 PD-1 / PD-L1 之间表达的相关性目前还没有一致性结论。 有研究表明,EGFR 基因突变可上调PD-L1 的表达来诱导免疫抑制性肿瘤微环境的产生,PD-L1 的高表达也会使伴有 EGFR 突变的NSCLC 患者对 EGFR-TKI 产生耐药性。但又有研究观察到 PD-L1 表达与 EGFR 突变存在显著相关性,且 PD-L1 阳性表达患者对 EGFR-TKI 药物的敏感度更高。 此外,还有研究表明 PD-1 / PD-L1 表达水平和肺癌中的 EGFR 突变没有显著关联性。以上矛盾的研究结论凸显了EGFR 突变状态和 PD-1 / PD-L1 之间的关系还存在很多未知,有待进一步探索。
继发性 EGFR 突变靶向治疗效果有限
本例患者在免疫治疗耐药进展之后的肿瘤组织分子病理学检测结果与2019年3月免疫治疗前的检测结果不同,提示治疗前的 EGFR 基因野生型状态在免疫治疗后出现了突变。 这种突变的发生可能与免疫治疗耐药有关,从而导致了患者病情再次快速进展。而此时针对 EGFR 突变的靶向药物能否为此类病人再次带来一定的缓解,目前还缺乏确切的临床研究,因为同类型病例非常罕见,难以开展临床研究。 此前 Chen Xia 报道的患者免疫治疗抵抗后出现 EGFR L858R 突变,使用吉非替尼2个月,但病灶持续进展,提示治疗无效。本例患者免疫治疗耐药后出现的 EGFR 突变状态更为复杂,同时存在EGFR L858R 经典突变和EGFR G873E 罕见突变。
在一项检测不同 EGFR 突变对EGFR-TKI 药物反应的体外研究中,EGFR G873E 对奥希替尼较为敏感。因此该例患者选择奥希替尼作为挽救性治疗药物,并且也取得了病灶退缩的疗效,但 PFS 时间仅维持了3. 3 个月。 这说明 NSCLC 患者免疫治疗耐药后出现的继发性 EGFR 突变不同于原发性EGFR 突变,对于 EGFR-TKI 类药物的反应差,这也从侧面再次证明了肺癌患者免疫治疗耐药分子机制的复杂性。
结语
总之,本例患者的临床发现提示了 EGFR 野生型肺腺癌患者在接受 PD-1 单抗药物治疗后出现EGFR 突变,或许是其获得性耐药的机制之一,但是何种原因引起的这种 EGFR 突变还未可知,仍需要进一步的研究。 对于该类患者的最佳治疗方法目前尚未明确,EGFR-TKI 类药物单独使用疗效欠佳,治疗策略还需要临床研究以进一步优化。 此病例同时也说明在肿瘤患者免疫治疗出现耐药后,再次行分子病理学检测是必要的。
参考文献
[1] HAN Y,LIU D,LI L. PD-1 / PD-L1 pathway: current researches incancer[J]. Am J Cancer Res,2020,10(3): 727 - 742.
[2] SHIN D S,ZARETSKY J M,ESCUIN-ORDINAS H,et al. Primaryresistance to PD-1 blockade mediated by JAK1 / 2 mutations[ J].Cancer Discov,2016,7(2): 188 - 201.
[3] XIA C,ZENG F,ZHANG Y. EGFR exon 21 L858R as an acquired resistance mechanism to nivolumab in a lung cancer patientoriginally driver gene-negative[J]. Thorac Cancer,2019,10(5):1256 - 1259.
[4] GELATTI A C Z,DRILON A,SANTINI F C. Optimizing the sequencing of tyrosine kinase inhibitors (TKIs) in epidermal growth factor receptor ( EGFR) mutation-positive non-small cell lung cancer (NSCLC)[J]. Lung Cancer,2019,137: 113 - 122.
[5] AKBAY E A,KOYAMA S,CARRETERO J,et al. Activation of the PD-1 pathway contributes to immune escape in EGFR-driven lung tumors[J]. Cancer Discov,2013,3(12): 1355 - 1363.
[6] PENG S,WANG R,ZHANG X,et al. EGFR-TKI resistance promotes immune escape in lung cancer via increased PD-L1 expression[J]. Mol Cancer,2019,18(1): 1 - 14.
[7] JI M,LIU Y,LI Q,et al. PD-1 / PD-L1 pathway in non-small-cell lung cancer and its relation with EGFR mutation [ J]. J Transl Med,2015,13: 1 - 6.
本站所注明来源为"爱爱医"的文章,版权归作者与本站共同所有,非经授权不得转载。
本站所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们
联系zlzs@120.net,我们将立即进行删除处理
热点图文
-
多参数MRI在前列腺癌精准诊断应用思考
随着前列腺癌发病率的逐年上升,精准诊断与分层治疗成为改善患者预后的关键。多...[详细]
-
带状疱疹神经疼痛的临床诊疗
综合治疗的必要性带状疱疹神经痛的治疗需要多模式、多学科的综合治疗策略。结合...[详细]

