前列腺癌骨寡转移,患者拒绝ADT,能否用SBRT替代且疗效如何?
前列腺癌骨寡转移,患者拒绝ADT,能否用SBRT替代且疗效如何?
摘要:一名72岁男性,诊断为前列腺癌,Gleason评分7(3+4),行根治性手术切除术,术后病理镜下切缘呈阳性,接受挽救性放疗。放疗结束后,患者拒绝雄激素剥夺疗法(ADT),8个月后出现骨转移,接受SBRT(stereotactic body radiotherapy,SBRT)治疗。在随后的10年里,随访期间又接受6个疗程的SBRT治疗新出现的骨转移。SBRT治疗后未观察到局部复发或毒性,KPS(Karnofsky Performance Status,KPS )评分为90%,该治疗方法为以后临床实践提供参考。
雄激素剥夺疗法(ADT)是治疗转移性前列腺癌的基础[1],化疗及新型内分泌药物如恩杂鲁胺、阿比特龙多用于前列腺癌的二线治疗。去势抵抗型前列腺癌广泛转移多表现内脏转移和/或4个骨病变,1个椎体和盆骨以外的骨病变,多西他赛可作为一线治疗选择[2]。肿瘤寡转移已成为一种独特的临床状态,处于局部和广泛转移中间状态。尽管关于确定寡转移的最大转移数量还没有达成共识,目前前列腺癌寡转移性通常被认为3个以内的骨或淋巴结转移[3]。寡转移在原发肿瘤得到控制的情况下可以通过局部治疗(如手术、放疗)得到有效的治疗。立体定向体放疗(SBRT)目前是治疗寡转移最佳放射治疗技术,该技术可以实现“精确定位、精确计划、精确治疗”,短时间内给与肿瘤消融放疗剂量[4]。
2013年至2019年发表的研究报告称选择SBRT治疗的前列腺癌骨转移患者,具有较高的局部控制率,且临床结果良好,无相关副作用[5]。有研究报道去势敏感的前列腺癌骨寡转移患者中,SBRT的基础上加入ADT并没有明显的改善疗效[6]。我们提供了一个经SBRT多次治疗后长期控制的前列腺癌骨寡转移病例,并且该患者没有接受ADT治疗。
患者,男性,72岁,高血压病史,2009年11月查体发现前列腺特异性抗原(PSA)水平升高4.7 ng/mL。穿刺活检确诊前列腺癌,Gleason评分7(3+4),完成前列腺癌根治性切除术。术后病理:局限在前列腺内,切除的淋巴结没有转移,显微镜下手术边缘呈阳性。术后3个月患者复查PSA水平为1.02 ng/mL;盆腔MR及骨扫描未发现转移。一个月后,完成术后瘤床挽救性放射治疗,完成总量79.2 Gy /44次。
在随访中,患者没有报告任何显著的肠道或泌尿系统不良事件,PSA降至0.7 ng/mL。6个月后升高至2.34 ng/mL。PET/CT显示左骶髂骨有一个小病灶放射示踪剂摄取增加,符合前列腺癌寡转移。ADT作为转移性前列腺癌的标准治疗方案被提出,但是患者因自身原因拒绝ADT。关于SBRT治疗前列腺癌骨转移的研究发表较少,但是SBRT被建议可以延迟ADT治疗。该患者被告知缺乏支持这种方法的科学证据。2010年10月,患者左侧骶髂骨转移灶给与SBRT治疗,完成剂量40Gy/5次。放疗结束后未出现并发症或放疗毒性,在随后的几个月,患者的PSA水平继续下降到最低点0.10 ng/mL。
2014年12月,患者首次SBRT 50个月后,PSA水平开始升高,新的PET/CT成像显示右侧骶髂关节放射示踪剂摄取增加,无疼痛(图1)。新的转移部位给与SBRT治疗,剂量40Gy/5次,患者PSA水平逐渐下降至0.15 ng/mL。
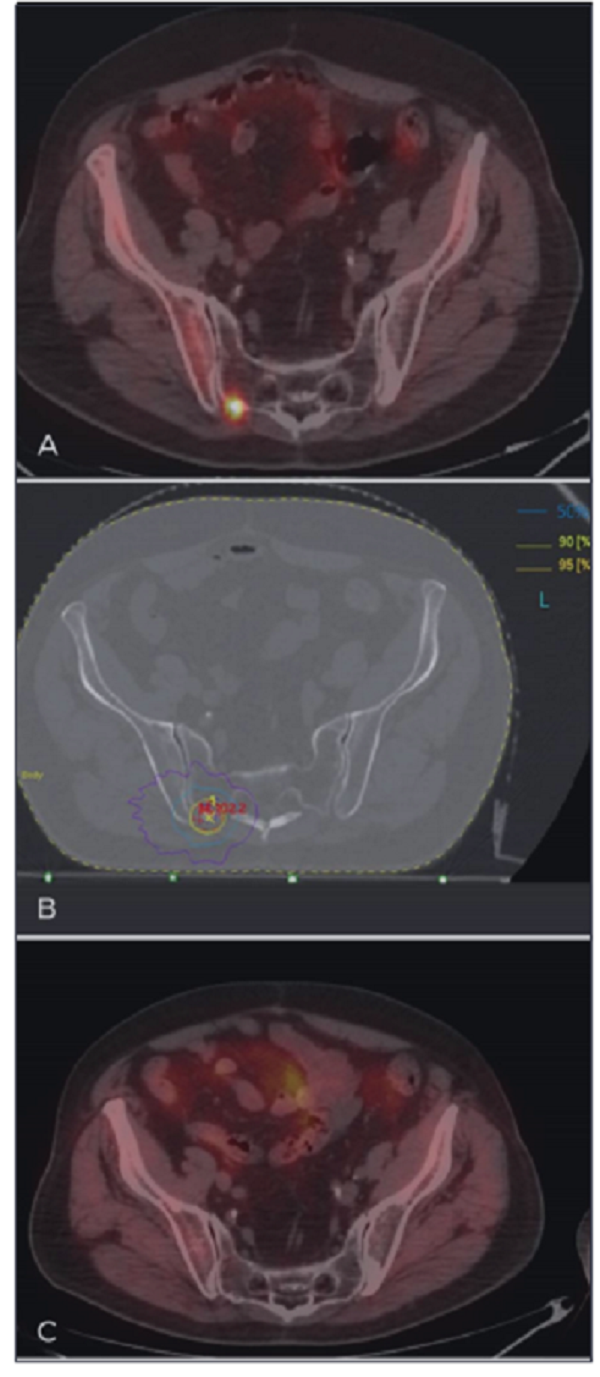
图1 (A) PET/CT显示右侧骶髂骨转移相对应小焦点放射示踪剂摄取增加;
(B)以40Gy/5次给予转移定向立体定向放疗;95%、50%和30%的等剂量分别为黄线、淡蓝色和紫线表示,靶区体积小(等剂量为95%)和剂量在靶外迅速下降(等剂量为30%);
(C) PET/CT成像显示照射10个月后右侧骶髂骨转移处未见放射示踪剂摄取
2016年7月,第二次SBRT治疗19个月后,患者PSA水平从0.15 ng/mL略微升高至0.35 ng/mL。PET/CT显示右髂翼放射示踪剂浓聚,完成SBRT 30 Gy/ 3次治疗。治疗后每3个月评估PSA一次,在治疗后12个月和22个月,PET/CT成像发现2个新的异时性盆腔骨转移性病变,每个病灶以30 Gy/3次进行SBRT治疗。
大约在前列腺手术后10年,在他第一次SBRT治疗骨转移9年后,患者的PSA水平从0.10 ng/mL上升到0.30 ng/mL。患者再次进行PET/CT检查,证实所有以前治疗过的骨部位未发现放射物质浓聚,但在第四胸椎前区发现了一个新的转移灶。继续SBRT治疗,放疗剂量为25 Gy/5次给予整个椎体,35 Gy/5次给予转移病灶,使用同步推量放疗技术。
2020年2月,患者在最后一次SBRT后11个月,PSA水平从0.13 ng/mL上升到0.57 ng/mL。PET/CT确定第二胸椎有小转移,进行SBRT治疗,以25 Gy/5次给予整个椎体,35 Gy/5次给予转移病灶(图2)。患者治疗后未观察到毒性,KPS评分为90%,未发生完全尿失禁,无局部复发,局部控制率100%。病人每4个月进行临床随访和PSA复查。截止2020年6月,患者83岁,突发心肌梗死去世。
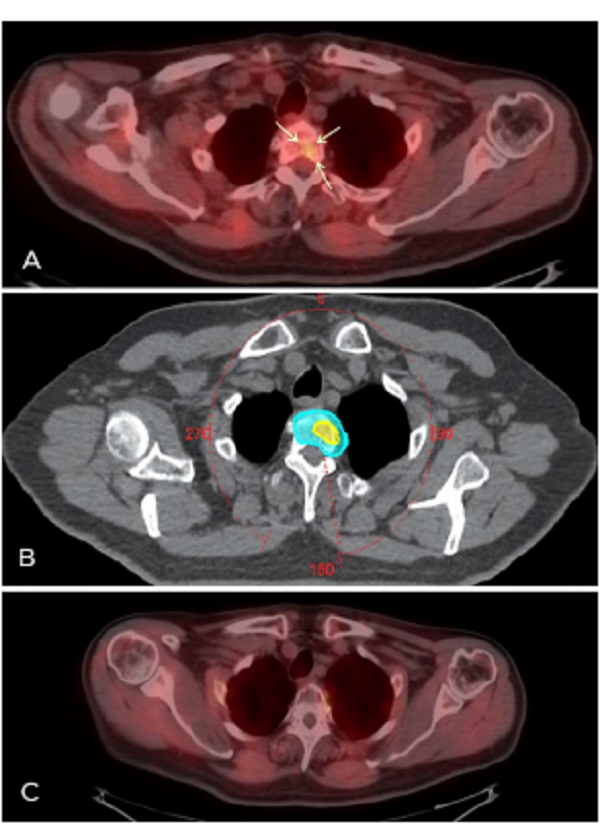
图2(A) PET/CT显示第二胸椎骨转移,伴放射示踪剂摄取增加的小病灶(箭头);
(B)转移灶立体定向体放疗体积:淡蓝色阴影为25Gy /5次照射体积;黄色阴影表示35 Gy/5次放射示踪剂摄取所对应的体积;
(C) PET/CT成像显示放疗后8个月第二胸椎转移没有放射性示踪剂摄取。
讨论
SBRT是前列腺癌骨寡转移一种有效的治疗方法,可引起PSA水平持续下降,重复SBRT治疗新发骨转移被认为是一种新兴的治疗方法。大多数研究表明SBRT在老年转移性前列腺癌患者中具有良好的耐受性。
这个案例中患者为前列腺癌骨寡转移,病人要求不影响生活质量,给予患者个体化SBRT治疗。当患者在2009年就诊时,考虑可能的副作用,他拒绝了标准的ADT治疗,但很少有研究发表关于SBRT作为ADT的替代治疗。然而,该患者当时选择SBRT治疗骨转移,在随后的10年里,对随访中遇到的其他骨转移进行了6次SBRT治疗。每疗程SBRT后,患者PSA水平下降,他的PSA在最近的随访中得到了控制(最后的PSA值为0.12 ng/mL),KPS表评分良好,没有治疗相关的毒性。
SBRT治疗前列腺癌骨寡转移性具有良好的效果和耐受性。早期局部治疗使用SBRT可能会延迟ADT的使用,这可能会避免一系列副作用如心血管疾病、性功能障碍、骨质疏松伴骨折、糖尿病和潮热等,从而不对生活质量产生负面影响[7]。
前列腺癌复发的一线成像选择是PET/CT,特别是带有前列腺癌特异性PET示踪剂,可以显示直径小于5毫米的肿瘤[5]。根据文献报道C-11胆碱和F-18胆碱是最常用的放射性示踪剂,而镓-68在PSA水平较低(<1 ng/mL)时更敏感[8]。即使PSA值未达到1ng /mL,患者每次PSA水平显著升高时,都会重复F-18胆碱PET/CT显像(图3)。最初采用这种方法是因为患者焦虑,但随着时间的推移,由于PET/CT能够在低PSA值情况下诊断出新的寡转移灶,因此后续继续采用这种方法。对于这个患者来说,PSA升高和PET/CT阳性之间的对应关系非常紧密,所以在每次放射学诊断后,骨寡转移部位都能及时进行SBRT治疗。
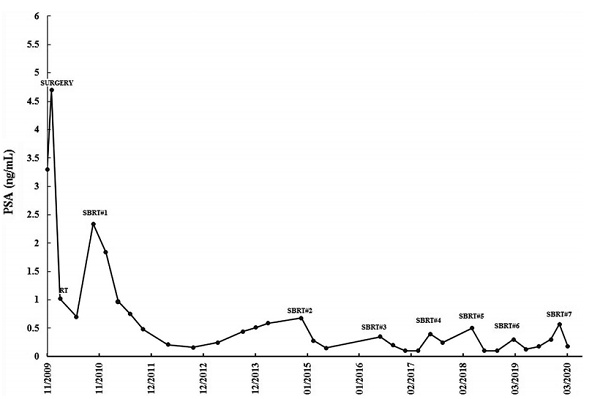
图3 PSA在SBRT治疗后变化
这种密切的随访和PET/ CT的检查数量可能不被接受,因为检查成本可能成为患者的负担。然而我们认为在这种情况下,ADT的成本和潜在的相关毒性将导致更糟糕的成本/疗效关系。对于特定的患者,多次寡转移SBRT治疗是一种有效的替代方式,可以给患者提供良好的生活质量。
参考文献
1.Cornford P, Bellmunt J, Bolla M, et al. EAU-ESTRO-SIOG.guidelines on prostate cancer. Part II: treatment of relapsing,metastatic,and castration-resistant prostatec cancer[J]. EurUrol.2017,71(4):630-642. doi:10.1016/j.eururo.2016.08.002 .
2.Gillessen S, Omlin A, Attard G, et al. Management of patients with advanced prostate cancer: recommendations of the St Gallen Advanced Prostate Cancer Consensus Conference(APCC)2015[J].AnnOncol.2015,26(8):1589-1604.doi:10.1093/annonc/mdv257 .
3.Gillessen S, Attard G, Beer TM, et al. Management of patients with advanced prostate cancer: the report of the Advanced Prostate Cancer Consensus Conference APCC 2017[J]. EurUrol.2018,73(2):178-211.doi:10.1016/j.eururo.2017.06.002.
4.James ND, de Bono JS, Spears MR, et al.; STAMPEDE,Investigators. Abiraterone for prostate cancer not previously treated with hormone therapy[J]. N Engl J Med. 2017,377(4):338-351. doi: 10.1056/NEJMoa1702900 .
5.Fizazi K, Tran N, Fein L, et al. Abiraterone plus prednisone in metastatic, castration-sensitive prostate cancer[J]. N Engl J Med. 2017,377(4):352-360. doi: 10.1056/NEJMoa1704174 .
6.Ingrosso G, T**pa F, Maranzano E, et al. Stereotactic body radiotherapy in oligometastatic prostate cancer patients with isolated lymph nodes involvement: a two-institution experience[J]. World JUrol. 2017,35(1):45-49.doi: 10.1007/s00345-016-1860-0 .
7.Triggiani L, Mazzola R, Magrini SM, et al.Metastasis-directed stereotactic radiotherapy for oligoprogressive castration-resistant prostate cancer: a multicenter study[J]. World J Urol. 2019,37(12):2631-2637. doi: 10.1007/s00345-019-02717-7.
8.Patel PH, Chaw CL, Tree AC, Sharabiani M, van As NJ. Stereotactic body radiotherapy for bone oligometastatic disease in prostate cancer[J]. World J Urol. 2019,37(12):2615-2621. doi: 10.1007/s00345-019-02873-w.
本站所注明来源为"爱爱医"的文章,版权归作者与本站共同所有,非经授权不得转载。
本站所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们
联系zlzs@120.net,我们将立即进行删除处理
热点图文
-
多参数MRI在前列腺癌精准诊断应用思考
随着前列腺癌发病率的逐年上升,精准诊断与分层治疗成为改善患者预后的关键。多...[详细]
-
带状疱疹神经疼痛的临床诊疗
综合治疗的必要性带状疱疹神经痛的治疗需要多模式、多学科的综合治疗策略。结合...[详细]

